Hallan una proteína responsable de la muerte celular que provoca un tipo de ceguera
CASTELLÓ. (EP). Científicos del Institut d'Investigació Biomèdica de Bellvitge (Idibell) han hallado una proteína responsable de la muerte celular causante de la amaurosis congénita de Leber (LCA12), una de las cegueras hereditarias más severas, que se manifiestan a edades muy tempranas.
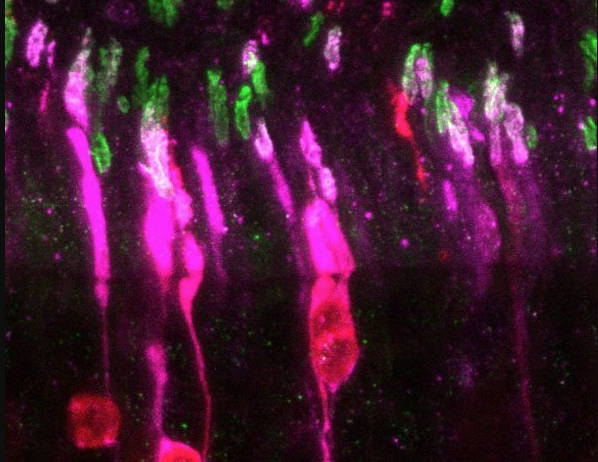
El estudio de un modelo animal de este tipo de ceguera ha permitido detectar las proteínas GCAP como mediadoras de la muerte celular en este tipo de cegueras, ha informado este jueves el Idibell en un comunicado.
Los investigadores han comprobado que la eliminación de estas proteínas retrasa la aparición de la patología, y el estudio desvela un mecanismo de daño sobre el que actuar a nivel terapéutico para retrasar la degeneración retinal en la LCA12 y potencialmente en otras cegueras similares.
Las cegueras equivalentes al daño por luz son aquellas causadas por algún tipo de desajuste fisiológico que conlleva que las células receptoras de la luz en la retina, conos y bastones, estén siempre excitadas, lo que acaba provocando la muerte celular, por lo tanto, la ceguera.
La excitabilidad de estas células se rige por la entrada o el freno al paso de iones a través de los canales de superficie, y en este tipo de cegueras los canales permanecen siempre cerrados, lo que resulta en una bajada crónica del calcio dentro de las células.
El equipo liderado por Ana Méndez ya postuló en trabajos previos que los sensores de calcio GCAP podrían ser los mediadores de la muerte celular en las células fotorreceptores ante esta bajada prolongada de calcio.
La LCA12 está causada por la mutación del gen RD3, lo que acaba provocando el cierre de los canales y la bajada crónica de calcio, y el estudio demuestra que en modelos animales si también se eliminan los sensores de calcio GCAP, la aparición de la ceguera se retrasa significativamente.
El estudio evidencia que los sensores GCAP se bloquean en su estado activo y se acumulan en un compartimento incorrecto de la célula, y apunta que las GCAP en el contexto de LCA12 activan algún mecanismo dentro de la célula que en último término conduce a estrés del retículo endoplásmico y a la apoptosis.
Méndez ha afirmado que existen más de 200 genes asociados a cegueras, en muchos casos minoritarias, y que aprender a modificar cada uno de estos genes puede resultar muy costoso, y que la "relevancia" del estudio radica en que se ha hallado un mecanismo de daño en el que podrían converger todas aquellas cegueras causadas por mutaciones que conllevan a una bajada crónica de calcio en la célula.