VALÈNCIA. De la inteligencia artificial a embriones sin óvulos y espermatozoides. Estas son algunas de las novedades que se han presentado esta semana en el X Congreso IVIRMA en Málaga. Los últimos hallazgos en reproducción asistida pueden ser la llave para la creación de tejidos y órganos que puedan ser utilizados en un futuro en transplantes humanos. En concreto, este equipo de investigadores liderado por el Dr. Jacob Hanna, del Departamento de Genética Molecular del Weizmann Institute of Science, crearon células sintéticas de ratón sin restricciones de desarrollo y descubrieron un potencial de desarrollo embrionario y extraembrionario en plataformas que simulaban un útero controladas electrónicamente, generando así embriones completos con órganos.
El resultado fue un modelo de embrión sintético de ratón con células progenitoras o especializadas con un corazón que late, un cerebro con pliegues bien formados, un saco vitelino, un tubo neural, un tracto intestinal, una placenta y una circulación sanguínea incipiente con tan solo ocho días de desarrollo, casi la mitad de los 20 días de gestación que requiere un ratón.
"El embrión es el punto de partida perfecto para generar órganos y la mejor bioimpresora en 3D, y eso es la clave para poder crear mecanismos que nos permitan hacer que las células madre se diferencien de las células especializadas del cuerpo o directamente formen órganos enteros. Esto ha sido muy complicado hasta ahora, y para lograrlo ha sido clave para ello liberar el potencial de autoorganización codificador de las células madre”, señala el Dr. Hanna, profesor asociado del Weizmann Institute of Science.

¿Cómo lo consiguieron? Como punto de partida, se basaron en avances anteriores de su laboratorio, como reprogramar células madre y devolverlas a su etapa más temprana. Además, contaban con la eficacia de un dispositivo que hacía las veces de útero para cultivar embriones de ratón (naturales, en esta investigación previa) mediante una solución nutritiva dentro de vasos que se mueven continuamente, simulando la forma en que los nutrientes son suministrados por el flujo sanguíneo a la placenta y controlando estrictamente el intercambio de oxígeno y la presión atmosférica.
En el nuevo estudio, el equipo se propuso cultivar un modelo de embrión sintético únicamente a partir de células madre de ratón que habían sido cultivadas durante años en una placa de Petri, prescindiendo de la necesidad de partir de un óvulo fecundado. Antes de colocar estas células en el dispositivo exútero, las dividieron en 3 grupos: un grupo en que se dejaron tal cual y otros dos que se pretrataron para dar lugar a tejidos extraembrionarios. Al mezclarlos en el dispositivo, un 0,5% formaron esferas que se convirtieron en una estructura similar a un embrión. Posteriormente, los investigadores pudieron observar la placenta y los sacos vitelinos formándose fuera de los embriones y el desarrollo del modelo sintético como en un embrión natural.
El objetivo más realista a largo plazo es estudiar cómo las células madre forman diversos órganos en el embrión en desarrollo para abrir nuevos horizontes terapéuticos en materia de trasplante de órganos. Esto podría dar lugar a la posibilidad de que algún día se puedan cultivar tejidos y órganos utilizando modelos de embriones sintéticos.
Pero para poder tener la posibilidad de desarrollar células con fines terapéuticos, es necesario comprender sus mecanismos de reprogramación y diferenciación, observando estas transiciones de las células madre durante de la embriogénesis y la organogénesis, además de estudiar el grado de equivalencia de las células in vitro con aquellas in vivo.
Además, este proyecto podría contribuir a simplificar el debate ético de experimentar con embriones naturales, además de reducir las pruebas en laboratorio con animales. En gran medida, se podría eludir los problemas técnicos y éticos que plantea el uso de embriones naturales en la investigación y la biotecnología. Incluso en el caso de los ratones, ciertos experimentos son actualmente inviables porque requerirían miles de embriones, mientras que el acceso a modelos derivados de células embrionarias de ratón, que crecen en incubadoras de laboratorio por millones, es prácticamente ilimitado.
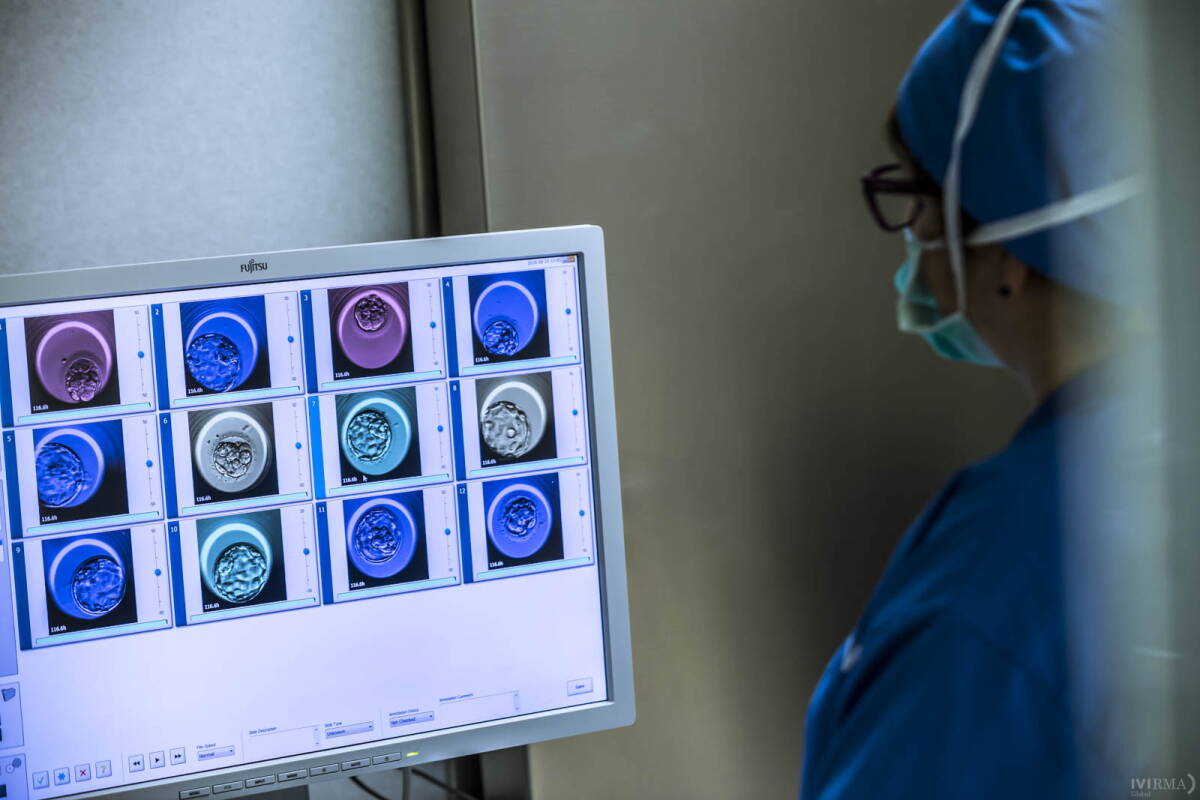
La importancia de la IA
Tradicionalmente, se han estudiado los parámetros que influyen en la morfología del embrión, que pueden relacionarse con sus posibilidades de implantación. Además, en los últimos años, las evaluaciones embrionarias realizadas mediante un sistema de time-lapse han proporcionado una comprensión más precisa del desarrollo embrionario, identificando diferentes parámetros morfocinéticos como marcadores de la viabilidad embrionaria, que han servido para definir modelos complementarios de selección de embriones. Sin embargo, tras los procedimientos de vitrificación y desvitrificación, los blastocistos sufren múltiples cambios morfológicos que pueden dificultar la evaluación de su calidad, y poco se sabe hasta el momento de la aplicación de esta tecnología a blastocistos vitrificados y desvitrificados.
Aquí es donde nace el estudio “Analysis of the morphological dynamics of blastocysts after vitrification/warming: defining new predictive variables of implantation”, liderado por el doctor Marcos Meseguer, supervisor científico de IVI y embriólogo de IVI Valencia.
“En nuestro trabajo evaluamos la dinámica post desvitrificación de los embriones para predecir el potencial de implantación de los blastocistos desvitrificados mediante el uso de Redes Neuronales Artificiales (RNA) basadas en Inteligencia Artificial (IA). En este sentido, estamos trabajando en un algoritmo de IA que estudia el comportamiento del embrión desde que se desvitrifica hasta que se transfiere, que tiene una duración de unas 4 horas aproximadamente. Así, la IA nos muestra que un embrión que inicia su expansión de manera precoz (cuando el tiempo medio de expansión es de 50 minutos) y realiza este proceso de forma rápida, adquiriendo una superficie superior a los 0,14 milímetros cuadrados, puede llegar a implantar hasta un 30% más que un embrión que se expande más tarde y lento durante esas primeras 4 horas de vida. La IA nos permite así identificar embriones que, aunque muestren buena morfología, tienen baja probabilidad de implantar porque al desvitrificarse, o han tardado mucho en expandirse o se han expandido muy poco”, explica el Dr. Meseguer.

Se trata de un análisis retrospectivo sobre una muestra de 511 blastocistos desvitrificados, cuyo objetivo principal es describir las variables implicadas en la dinámica morfológica de los blastocistos vitrificados y posteriormente desvitrificados durante el periodo de tiempo entre la desvitrificación y la transferencia embrionaria en un intento por comprender mejor el procedimiento de reexpansión del embrión.
“Cuando vitrificamos el embrión, lo dejamos en estado inerte, quitándole el agua, que es la que mueve toda la maquinaria de la célula. En el momento en que le quitas el agua, es como si el tiempo se detuviera, y el embrión puede permanecer años así sin que el tiempo repercuta negativamente en su calidad. Cuando reactivamos el tiempo, le volvemos a meter el agua al embrión, que entra poco a poco y no en todos los embriones lo hace de la misma manera. Este proceso de entrada de agua y salida del anticongelante -que es el crioprotector- no lo realizan todos los embriones igual, ni todos comienzan al mismo tiempo. Y este es el punto de partida de nuestro trabajo: hemos visto que aquel embrión en el que antes empieza a entrar el agua presenta mejor pronóstico. Y a aquel embrión que se expande más rápidamente le va a ir mejor que a aquel que se expanda más lentamente. Esto nos lleva a correlacionar la reexpansión de los blastocistos desvitrificados con sus posibilidades de implantación. Así, más del 60% de los blastocistos reexpandidos implantaron exitosamente, frente al 6% de los que no se reexpandieron tras la desvitrificación”, comenta el Dr. Meseguer.
En la actualidad, es práctica habitual el cultivo prolongado de embriones y la transferencia en fase de blastocisto, lo cual ha demostrado una mejora en la selección embrionaria y, por ende, en las tasas de éxito de los tratamientos reproductivos. Esta estrategia implica la criopreservación de todos los blastocistos viables y su transferencia en ciclos posteriores, evitando así a su vez el riesgo de hiperestimulación ovárica.
Este aumento creciente de los ciclos de transferencia en diferido ha potenciado el desarrollo de criterios de selección cada vez más precisos para mejorar los resultados de las transferencias de blastocistos vitrificados.
“Es bien sabido que cada observación implica la exposición a condiciones subóptimas fuera del entorno controlado de una incubadora, lo que puede afectar potencialmente al éxito del tratamiento. De ahí que la monitorización continua de blastocistos desvitrificados mediante sistemas de lapso de tiempo pueda proporcionarnos información valiosa sobre su potencial de implantación mientras permanecen en un entorno de cultivo estable y controlado. En este punto, es importante recalcar que todos los blastocistos fueron vitrificados y desvitrificados mediante el método Cryotop, y se colocaron en el EmbryoScope inmediatamente después de la desvitrificación hasta su transferencia. Además, otro elemento diferencial de nuestro trabajo apunta al hecho de que este proporciona valores cuantitativos objetivos para las variables implicadas en la reexpansión de blastocistos, a diferencia de la evaluación morfológica subjetiva que se ha utilizado para la reexpansión de blastocistos realizada hasta la fecha”, aclara el Dr. Meseguer.
Podemos concluir de esta manera que el análisis mediante Inteligencia Artificial de la dinámica de blastocistos vitrificados y desvitrificados podría ser útil para predecir su potencial de implantación. Por tanto, el uso de modelos predictivos en ciclos vitrificados podría evitar la transferencia de embriones vitrificados con baja tasa de éxito. No obstante, las correlaciones observadas y el algoritmo propuesto deben validarse en un ensayo prospectivo para evaluar su eficacia.





















